Torres Pombo, Jesús Lama Varela, Antonio
Centro de Seguridade e Saúde Laboral de Pontevedra / Consellería de Asuntos Sociais, Emprego e Relacións Laborais / Xunta de Galicia / Rande-Redondela-Pontevedra, Apartado 1599-Vigo, Pontevedra, España
34 986 400 400 / segur.hixiene.rande@xunta.es
ABSTRACT
La concentración de mercurio en orina se utiliza como indicador biológico de exposición laboral a mercurio. La determinación de mercurio se realiza por espectrofotometría de absorción atómica por vapor frío. Sin embargo, al adaptar estos métodos al análisis mediante FIAS aparecen ciertas dificultades que afectan a la sensibilidad y exactitud del método. En el presente trabajo se analizan las condiciones de preparación de la muestra de orina y de análisis. Proponemos un método de análisis sencillo que, realizando la digestión de la muestra con ácido nítrico y empleando como reductor cloruro estañoso, consigue una aceptable sensibilidad de 0’5 µg/l.
Palabras clave
Mercurio en orina, control biológico, FIAS
INTRODUCCIÓN
El control biológico de la exposición laboral a mercurio (Hg) se lleva a cabo a través de la determinación del mercurio inorgánico total presente en la orina o del mercurio inorgánico total en sangre. Este valor límite biológico (VLB) utilizando como indicador el mercurio en orina está establecido en 35 µg /g creatinina [1, 2]. La determinación de mercurio en orina se realiza por espectrofotometría de absorción atómica por la técnica de vapor frío. Esta técnica requiere una oxidación previa de la muestra con permanganato potásico y un tratamiento posterior con una mezcla de ácidos minerales en frío. El mercurio iónico presente en la muestra se reduce a mercurio elemental utilizando borohidruro sódico [3]. Una alternativa a este tratamiento es utilizar únicamente ácido nítrico como agente oxidante y cloruro estañoso como reductor del mercurio iónico [4]. Actualmente este tipo de análisis pueden automatizarse empleando un inyector de flujo (FIAS). Con esta técnica se consigue un considerable ahorro de tiempo y de reactivos, así como una mejora en la repetibilidad de los resultados. Sin embargo, a la hora de trasladar los métodos anteriores podemos encontrar ciertas dificultades.
Las condiciones óptimas de funcionamiento del FIAS que se han establecido para la determinación de mercurio en muestras acuosas [5] no son válidas para las muestras de orina porque la concentración de ácido nítrico necesaria para llevar a cabo una correcta oxidación de la muestra va a condicionar el análisis. Hemos comprobado que la respuesta obtenida para una concentración dada de mercurio, es dependiente de la concentración de nítrico presente. Al aumentar la
concentración de nítrico disminuye la absorbancia. Es necesario pues establecer unas condiciones de análisis que tengan en cuenta estos factores y buscar un compromiso entre la dilución de la muestra y la concentración final de ácido nítrico que asegure una sensibilidad aceptable en la determinación de mercurio en orina.
MATERIALES Y MÉTODOS
Reactivos
Ácido clorhídrico concentrado, ácido nítrico concentrado y cloruro estañoso, todos ellos exentos de mercurio, calidad para análisis de Merck.
Equipos y condiciones de análisis
Espectrofotómetro de absorción atómica Perkin-Elmer 1100B, FIAS 400 de Perkin Elmer y un muestreador automático AS-90.
Las condiciones de funcionamiento del FIAS son las recomendadas en el manual del fabricante [5]. Como portador hemos utilizado una solución de 3% de HCl concentrado y como reductor 2% de SnCl2 en 3% de HCl. La longitud de onda de lectura son 253’7 nm y la curva de calibración se hace en función de la altura de pico.
Métodos
Para determinar la concentración de ácido nítrico necesaria para que la digestión de la muestra de orina se lleve a cabo de modo efectivo, se procedió a tratar una muestra de orina que contenía mercurio como se indica en la tabla I. A todas las muestras se les añadió agua destilada hasta completar un volumen final de 4 ml, a fin de que la dilución final fuera igual para todas ellas.
Tabla I.- Preparación de muestras de orina con diferentes concentraciones de ácido nítrico.
|
Volumen orina (ml) |
Volumen HNO3 (ml) |
Volumen H2O (ml) |
Concentración final de HNO3 (%) |
|
2 |
0’2 |
1’8 |
5 |
|
2 |
0’5 |
1’5 |
12’5 |
|
2 |
1’0 |
1’0 |
25 |
|
2 |
1’5 |
0’5 |
37’5 |
|
2 |
2’0 |
0’0 |
50 |
Los patrones acuosos de 20 µg de Hg/l, con distintas concentraciones de ácido nítrico se prepararon tal y como se indica en la tabla II. A 0’5 ml de una solución que contiene 1 mg de Hg/l se añadieron 0’5, 2’5, 5’0, 7’5, 10’0, 12’5 y 15’0 ml de HNO3, en función de la concentración final de ácido que se desea obtener. Finalmente, se añade agua desionizada hasta completar 25 ml. Los patrones acuosos así obtenidos tienen una concentración de mercurio de 20 µg/l y concentraciones del 2, 10, 20, 30, 40, 50 y 60 % de HNO3.
Tabla II.- Preparación de patrones de 20 ppm de Hg con diferentes concentraciones de ácido nítrico.
|
Patrón de 1ppm de Hg (ml) |
HNO3(ml) |
H2O(ml) |
Concentración de Hg (ppb) |
% de nítrico |
|
0’5 |
0’5 |
24 |
20’0 |
2 |
|
0’5 |
2’5 |
22 |
20’0 |
10 |
|
0’5 |
5’0 |
19’5 |
20’0 |
20 |
|
0’5 |
7’5 |
17’0 |
20’0 |
30 |
|
0’5 |
10’0 |
14’5 |
20’0 |
40 |
|
0’5 |
12’5 |
12’0 |
20’0 |
50 |
|
0’5 |
15’0 |
9’5 |
20’0 |
60 |
Los patrones acuosos y las muestras de orina de 20 µg de Hg/l, con distintas concentraciones de ácido nítrico se prepararon tal y como se indica en la tabla III, para tener un volumen final de 25 ml y una concentración de ácido nítrico comprendida en entre 20 y 50%. También se preparó un blanco de orina al que no se le añadió mercurio.
Tabla III.- Preparación de patrones acuosos y orinas a las que se añadió 20 ppm de Hg, con diferentes concentraciones de ácido nítrico.
|
Agua / orina (ml) |
Patrón de 1ppm de Hg(ml) |
HNO3(ml) |
Concentración de Hg (ppb) |
% de nítrico |
|
19’5 |
0’5 |
5’0 |
20’0 |
20 |
|
18’25 |
0’5 |
6’25 |
20’0 |
25 |
|
17’0 |
0’5 |
7’5 |
20’0 |
30 |
|
15’75 |
0’5 |
8’75 |
20’0 |
30 |
|
14’5 |
0’5 |
10’0 |
20’0 |
40 |
|
13’25 |
0’5 |
11’25 |
20’0 |
35 |
|
12’0 |
0’5 |
12’5 |
20’0 |
50 |
RESULTADOS Y DISCUSIÓN
Concentración de ácido nítrico necesaria para la digestión de la muestra
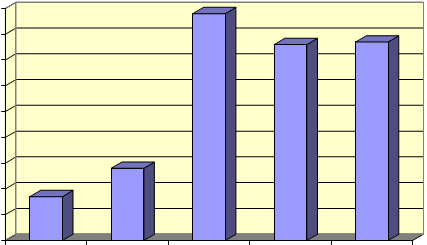
En la figura I se puede ver la relación existente entre la concentración de nítrico utilizada para la digestión de una muestra de orina que contiene mercurio y la respuesta obtenida expresada en unidades de absorbancia.
Fig. 1. Efecto de la concentración de ácido nítrico sobre la digestión de la muestra
90
 |
|
80 70 |
60
 |
|
50 40 30 20 10 0 |
5 12,5 25 37,5 50
% de ácido nítrico
Como se puede apreciar, para concentraciones de nítrico inferiores al 25% la respuesta es mucho menor que la obtenida para las concentraciones de nítrico del 25% o superiores. Esto es indicativo de que con concentraciones de ácido nítrico inferiores al 25% la oxidación de la muestra no es completa. Al aumentar la concentración de ácido nítrico por encima del 25% se produce una ligera disminución en la absorbancia que se relaciona con la disminución de la sensibilidad del método al aumentar la concentración de ácido nítrico.
Efecto de la concentración de ácido nítrico sobre la respuesta en patrones acuosos
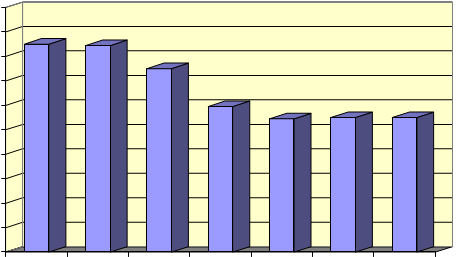
Como se ha visto, para que se produzca la oxidación adecuada de la orina es necesario una elevada concentración de ácido. Es necesario, pues, estudiar como afecta la variación en la concentración de ácido a la respuesta, tanto en patrones acuosos como en muestras de orina. En la figura 2 se muestra el efecto que la concentración de ácido nítrico tiene sobre la respuesta para patrones acuosos con 20 µg de Hg/l.
Fig. 2 . Efecto de la concentración de ácido nítrico sobre la respuesta en patrones acuosos
200
 |
|
180 160 |
140
 |
|
120 100 80 60 40 20 0 |
1 10 20 30 40 50 60
% ácido nítrico
La mayor absorbancia se observa en concentraciones de ácido nítrico inferiores al 10%. Luego se produce una disminución de la respuesta que se hace aproximadamente constante entre el 40 y 60%.
Efecto de la concentración de ácido nítrico sobre la respuesta en muestras de orina
Con el fin de estudiar si el efecto que, sobre la respuesta, produce la concentración de ácido nítrico es similar en patrones acuosos y en muestras de orina, se prepararon muestras acuosas y de orina, a las que se adicionó mercurio hasta una concentración de 20’0 µg de Hg/l, con distintas concentraciones de ácido nítrico. Partimos de un mínimo del 25% de ácido nítrico que es la concentración mínima que garantiza una correcta oxidación de la muestra.
En la figura 3 se comparan el efecto que la concentración de ácido nítrico ejerce sobre la respuesta de patrones acuosos y de muestras de orina.
Como se puede apreciar, la tendencia es similar en los patrones acuosos y en las muestras de orina.
Hay que señalar que, en algunas muestras de orina, tras la adición de ácido nítrico, al enfriar, se produce un precipitado que resulta de la cristalización de determinadas sales. En tales casos, para disolver el precipitado es necesario diluir la muestra, pero la concentración final de ácido ha de ser siempre igual o superior al 25%.
Fig. 3. efecto de la concentración de ácido nítrico sobre la respuesta en patrones acuosos y en orinas
160
 |
|
140 |
120
100
80
60
40
Patrón acuoso de 20 ppb de Hg
orina 20 ppb de Hg
Blanco acuoso Blanco orina
 |
|
20 0 |
20 25 30 35 40 45 50 55
% de ácido nítrico
Los datos anteriores indican que las muestras de orina ha de tratarse con ácido nítrico para obtener una concentración mínima de 25% de ácido. Nosotros, aunque a mayor concentración de ácido se produce una ligera disminución de la absorbancia y teniendo en cuenta que la sensibilidad del método cubre las necesidades del control biológico, hemos optado por utilizar una concentración final del 33% de ácido (2ml de orina : 1ml de ácido nítrico) que garantice una correcta oxidación de la muestra.
Linealidad de respuesta
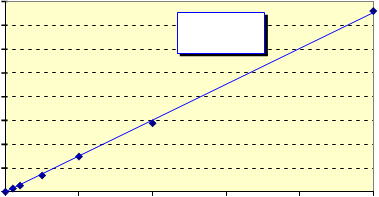
Se ha comprobado la linealidad de la respuesta, para patrones preparados con un 33% de ácido nítrico, entre el intervalo comprendido entre 0’0 y 50’0 µg/l (figura 4).
Fig. 4. Linealidad de respuesta para patrones acuosos con un 33% de ácido nítrico
400
350
300
250
200
150
y = 7,5323x R2 = 0,9993
100
50
0
0 10 20 30 40 50
Concentración de mercurio (µg/l)
La validez del método se comprueba en los resultados obtenidos en el control de calidad (Tabla IV)
Tabla IV. Resultados obtenidos en el análisis de las muestras de un control de calidad externo.
|
Identificación |
Valor observado |
Valor diana |
Rango aceptable |
|
256 |
51’2 |
54’2 |
43-65’4 |
|
257 |
69’3 |
74’0 |
58-90 |
|
258 |
179’1 |
175’7 |
138’5-212’9 |
DISCUSIÓN
Para llevar a cabo una correcta oxidación de las muestras de orina es necesario que la concentración final de ácido nítrico sea al menos de un 25 % (figura 1). Se ha comprobado que la respuesta disminuye al aumentar la concentración de ácido para los patrones acuosos, haciéndose prácticamente constante a partir del 40 % de ácido nítrico (figura 2). Para garantizar una correcta oxidación de las muestras de orina que contienen mercurio endógeno, la concentración de ácido nítrico ha de ser del 33%. A esta concentración existe una buena correspondencia entre los valores de los patrones acuosos y a las muestras de orina (figura 3).
Proponemos el siguiente tratamiento: añadir 2 ml de ácido nítrico a 4 ml de orina. La concentración final de ácido es del 33% y la dilución final de la muestra de 2/3. Se ha comprobado la linealidad de respuesta para patrones acuosos en el intervalo comprendido entre 0 y 50 ppb (fig. 4). En estas condiciones puede detectarse cantidades de 0’5 µg de Hg/l.
BIBLIOGRAFÍA
[1] Instituto Nacional de Seguridad e Higiene en el Trabajo (2002). Límites de exposición profesional para agentes químicos en España 2003. Edita: Ministerio de Trabajo y Asuntos Sociales, INSHT, Madrid, España: 160 p.
[2] American Conference of Governmental Industrial Hygienists (2000). TLVs® Threshold Limit Values and Biological Exposure Indices for 2000.Edita: ACGIH, Cincinnati, OH.
[3] Asociación Española de Normalización y Certificación (1998). Norma UNE 81595. Control biológico. Determinación de mercurio en orina. Método de vapor frío con borohidruro de sodio. Espectrofotometría de absorción atómica. Edita: AENOR, Madrid, España: 11p.
[4] Instituto Nacional de Seguridad e Higiene en el Trabajo (1994). MTA/MB- 019/A94: Determinación de mercurio en orina – método del vapor frío con cloruro de estaño / espectrofotometría de absorción atómica. Edita: Ministerio de Trabajo y Asuntos Sociales, INSHT, Madrid, España: 5 p.
[5] Perkin-Elmer (1994). Flow injection mercury/hidride analyses: recommended analytical conditions and general information. Publication B3505. Edita Perkin- Elmer.
Papers relacionados