Sousa Rodríguez, María Encarnación Salamanca Domínguez, Álvaro J. Pérez Herrero, Carlos
Instituto Nacional de Seguridad e Higiene en el Trabajo (CNNT).Madrid/ Calle Torrelaguna, 73/ 28027 Madrid, España
+34 91 363 42 14 / esousaro@mtas.es
ABSTRACT
Se ha puesto a punto un método analítico para la determinación de cobre en suero, plasma y orina mediante la técnica de cámara de grafito con corrección de fondo Zeeman. La muestra se inyecta en el horno de grafito tras una dilución con HNO3 y Tritón X-100 al 0,1%, utilizándose, para la cuantificación de la misma, una curva de adición. El análisis de materiales de referencia, controles de calidad externos y la participación en el programa tipo “round robin” de la Universidad de Erlangen han puesto de manifiesto la idoneidad del método para llevar a cabo el análisis de cobre en matrices biológicas.
Palabras clave
Cobre, plasma, suero, orina, cámara de grafito
INTRODUCCIÓN
El cobre es un elemento esencial para los seres humanos. Forma parte de diversas enzimas, algunas de ellas con funciones tan importantes para el organismo como la protección del mismo frente a los radicales libres. Las necesidades diarias de cobre en adultos se estima que son del orden de los 2 mg según la Organización Mundial de la Salud (OMS) [1].
Sus propiedades físico-químicas hacen que el cobre, sus aleaciones y compuestos cuenten con un gran número de aplicaciones en diversos sectores, tales como, construcción, telecomunicaciones y agricultura. Por poner algunos ejemplos, el cobre se emplea en cables, tuberías, sistemas térmicos, techumbres, como componente en pinturas para fondos de embarcaciones, en pigmentos y como fungicida vegetal [2].
La principal ruta de entrada en el organismo es la absorción gastrointestinal, sin embargo, desde el punto de vista laboral, puede tener lugar la inhalación de cobre o compuestos de cobre cuando éstos se encuentran en el puesto de trabajo en forma de humos, nieblas o partículas [3]. Una vez dentro del organismo, el cobre se almacena, principalmente, en el hígado, cerebro, corazón, riñones y músculos. La eliminación del mismo tiene lugar a través de la bilis y, en mucha menor proporción, en la orina. Se estima que el tiempo de vida media es de cuatro semanas [2].
En cuanto a su toxicidad, la exposición a humos de cobre puede provocar irritación de la parte superior del tracto respiratorio, náuseas e incluso “fiebre por humos metálicos”. La inhalación de polvos y nieblas de sales metálicas puede causar irritación nasal y en ocasiones ulceración con perforación del tabique nasal. La ingestión de dichas sales puede originar diversos problemas gastrointestinales. Las
exposiciones durante periodos de tiempo prolongados pueden causar anemia, aunque en el caso del cobre no se han observado casos de toxicidad crónica como sucede con otros metales, tales como plomo y cromo [4].
En lo que respecta a la toxicocinética de este elemento se puede apreciar cómo tanto el cobre en suero como en orina son posibles indicadores biológicos de la exposición. Diversos estudios apuntan a que los niveles normales en plasma o suero están entorno a 110µg/100ml, mientras que los de orina están comprendidos entre 15 y 36µg/24 horas [3]. Lauwerys ofrece los siguientes valores de referencia para el cobre en los fluidos biológicos estudiados [3]:
Orina: <50µg/g creatinina Suero: <140µg/100ml
Si bien, cabe considerar que los niveles pueden variar en caso de embarazo, procesos infecciosos o inflamatorios y como consecuencia de enfermedades hepáticas. Otro caso en el que no se mantienen estos niveles en suero y orina los encontramos en las personas que padecen la enfermedad de Wilson, enfermedad que se caracteriza por la acumulación excesiva de cobre en el organismo. En la sangre se observa un descenso de la ceruloplasmina y una elevación del cobre libre, mientras que la excreción urinaria es elevada [2].
La determinación de cobre en matrices biológicas se puede abordar mediante diferentes técnicas analíticas, siendo las más comunes las que tienen su base en la absorción atómica. En lo que se refiere a las técnicas de emisión atómica (ICP-AES e ICP-MS), éstas son las elegidas por NIOSH (National Institute for Occupational Safety and Health) [5] y DFG (Deutsche Forschungsgemeinschaft) [1] para llevar a cabo la determinación de cobre, junto a otros metales, en sangre y en orina de trabajadores laboralmente expuestos a ese metal.
En este trabajo se propone un método analítico para la determinación de cobre en plasma, suero y orina. Este método se basa en realizar una dilución de la muestra y a continuación analizarla mediante cámara de grafito con corrector Zeeman. En este artículo se tratan los aspectos a tener en cuenta desde que se realiza la toma de muestra hasta que se llega al resultado analítico.
OBJETIVO
Este trabajo tiene como finalidad la puesta a punto de un método analítico para la determinación de cobre en matrices biológicas de trabajadores expuestos a dicho metal. Para evitar una posible contaminación de la muestra, la manipulación de la misma se reducirá al mínimo. La determinación de cobre se llevará a cabo mediante la técnica de absorción atómica de cámara de grafito con corrección Zeeman. Para validar el procedimiento analítico se emplearán materiales de referencia así como muestras de controles de calidad externos.
MATERIALES Y MÉTODO
Aparatos
En este trabajo se utilizó un espectrofotómetro de absorción atómica Analyst 800 con corrección de fondo Zeeman de Perkin Elmer (Norwalk, CT, EE.UU.) equipado con una cámara de grafito con calentamiento transversal (THGA) y un inyector automático AS-800, ambos de Perkin Elmer. Se utilizaron dos modelos de tubos de grafito de calentamiento transversal (THGA), el estándar para muestras de suero/plasma y el tubo con End Caps para las muestras de orina, ambos también de
Perkin Elmer. Como fuente de radiación se empleó una lámpara de cátodo hueco de cobre (Perkin Elmer).
Las muestras se homogenizaron con un agitador rotatorio modelo Movil-Rod de JP Selecta y se prepararon en cubiletes de polipropileno de 1,1ml de capacidad utilizando pipetas automáticas Eppendorf modelo Research.
Reactivos
Para preparar las disoluciones se utilizó agua ultrapura obtenida mediante un sistema Milli-Q gradient A 10 y un sistema RiOs 5 de Millipore (resistividad = 18.2 MΩ.cm y TOC = 1-5 ppb).
En este estudio se utilizó un patrón comercial de cobre Titrisol (ref. 1.09987.0001) de Merck (Dartmstadt, Alemania), Tritón X-100 (ref. BP151-100) de FisherBiotech (New Yersey, EE.UU.) y ácido nítrico al 60% para análisis ISO (ref. AC 1604) de Scharlab (Barcelona).
El método se validó mediante materiales de referencia y muestras procedentes de controles de calidad externos. El material de referencia para validar el método de determinación de cobre en suero fue Medisafe Metalle S-4A de Medichem (Steinenbronn, Alemania). Para validar el método de cobre en orina se emplearon los materiales Lyphochek Urine Metals Control de BIO-RAD (EE.UU.) y el Standard Reference Material 2670a (toxic elements in urine) del National Institute of Standards and Technology (NIST) (EE.UU.). Los materiales de referencia empleados fueron regenerados siguiendo las instrucciones del fabricante.
En el proceso de validación, se utilizaron, además, muestras de control de calidad procedentes de los programas externos Interlaboratory Comparison Program for Metals in Biological Samples (PCI), Centre de Toxicologie du Québec y External Intercomparison Programme 36, 2005 for toxicological analyses in biological materials, Institute and Outpatient Clinic for Occupational, Social and Environmental Medicine of the University of Erlangen-Nuremberg.
Toma de muestra
En la determinación de metales en muestras de plasma o suero, se obtiene el plasma o suero mediante centrifugación y se transfiere a un tubo de plástico [6]. Las posibles fuentes de contaminación son las jeringas, los tubos y el anticoagulante empleado. Si el análisis no se realiza inmediatamente, la muestra se puede conservar a +4ºC durante cinco días y más tiempo en caso de estar congelada. Como regla general la muestra se toma al final del turno del tercer día de trabajo [7].
Las muestras de orina se recogen en frascos de polietileno. Si la orina no se analiza inmediatamente, se conserva a +4ºC durante una semana y a -18ºC durante más tiempo. Aunque en otros campos se utilizan muestras de orina de 24 horas, la práctica habitual en Higiene Industrial es tomar muestras puntuales [1]. La DFG recomienda una recogida de muestra al final del turno del tercer día de trabajo [7].
Las fuentes de error de esta etapa de toma de muestra son la contaminación de la orina con partículas de polvo presentes en la piel y en la ropa y las pérdidas por adsorción. Para evitar la contaminación de la muestra se utilizan recipientes lavados previamente con HNO3, mientras que las pérdidas por adsorción se evitan acidificando la orina con HNO3 o ácido acético, de modo que resulte una concentración final del 1% [7].
Procedimiento de análisis
Antes del análisis mediante cámara de grafito, la muestra se lleva a temperatura ambiente y se homogeniza mediante un agitador rotatorio. La preparación de la muestra para su inyección en el horno de grafito consiste en realizar una dilución 1/20 del suero o plasma o una dilución 1/10 para la orina empleando como agente diluyente una disolución de Tritón X-100 y HNO3 al 0,1%. La adición de ácido tiene como finalidad liberar los iones metálicos de sus uniones con la matriz de la muestra, mientras que el Tritón X-100 previene la precipitación y reduce la tensión superficial de la disolución.
Cuando se analiza suero o plasma se depositan en un cubilete 40µl de muestra y 760µl de diluyente y se homogeniza la disolución. La preparación de la orina es similar, en este caso se toman 60µl de muestra, 240µl de agua y 300µl de diluyente. Junto con las muestras se deben preparar blancos para detectar la posible presencia de cobre en los reactivos y material empleados, y efectuar las oportunas correcciones.
Para cuantificar el cobre presente en la muestra, se emplea una recta de adición. La recta de adición para el suero o plasma se prepara depositando en el cubilete 40µl de muestra, a los cuales se les añade 40µl de patrón de distintas concentraciones y 720µl de diluyente. Cuando la matriz a analizar es orina, se procede de modo similar, se pipetean 60µl de orina, 60µl de patrón de distintas concentraciones, 180µl de agua y 300µl de diluyente.
Los blancos patrones y muestras, se analizan mediante la cámara de grafito con corrección de fondo Zeeman utilizando un volumen de inyección y un tubo de grafito diferente para cada tipo de matriz. Los volúmenes de inyección son 5 y 10µl para suero/plasma y orina, respectivamente. En ambos casos se emplean tubos de grafito calentados transversalmente (THGA), el estándar cuando muestra es suero/plasma y el tubo con End Caps cuando la muestra es orina.
La determinación de cobre se realiza a 324,8nm, con una rendija de 0,7nm y siguiendo el programa de temperaturas indicado en la tabla 1. La lectura del cobre en la muestra se efectúa en área de pico.
Tabla 1. Programa de temperaturas empleado en la determinación de cobre en fluidos biológicos.
|
Etapa |
Temperatura/ºC |
Rampa/s |
Isoterma/s |
Flujo Ar/ ml min-1 |
Lectura |
|
Secado |
110 |
5 |
30 |
250 |
|
|
Secado |
130 |
1 |
30 |
250 |
|
|
Mineralización |
920 |
25 |
20 |
250 |
|
|
Atomización |
2000 |
0 |
5 |
0 |
X |
|
Limpieza |
2450 |
1 |
4 |
250 |
|
|
Recuperación |
20 |
1 |
5 |
250 |
RESULTADOS Y DISCUSIÓN
La optimización de las temperaturas de mineralización y atomización es uno de los pasos a realizar cuando se pone a punto un método analítico. En la figura 1 se muestran las curvas de mineralización y atomización para una muestra de orina adicionada con cobre.
0,250
 |
|
0,200 |
0,150
 |
||||
0,1000,050 |
0,000
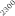
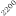
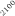
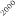
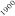
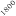
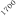
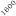
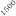
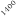
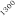
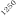
Temperatura / ºC
Figura 1. Optimización de las temperaturas de mineralización y atomización.
Teniendo en cuenta las curvas de la figura 1 y la forma del pico se seleccionaron unas temperaturas de 920 y 2000ºC para la mineralización y la atomización, respectivamente. Con una temperatura de mineralización de 920ºC se consigue disminuir el efecto de la matriz en la determinación y con la atomización a 2000ºC se pretende prolongar la vida del tubo de grafito.
Para estudiar las características del método se siguieron las directrices indicadas en el protocolo de validación para determinaciones en muestras biológicas (sangre y orina) de interés en higiene industrial [8] publicado por el Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT).
Para calcular el sesgo y la precisión se utilizaron materiales de referencia. Los ensayos se efectuaron en varios niveles de concentración analizándose seis muestras por cada concentración estudiada. Los resultados obtenidos se pueden consultar en la tabla 2. Dado que los materiales empleados no son certificados, el sesgo calculado se debe de considerar como indicativo.
Tabla 2: Cálculo del sesgo y de la precisión.
|
Medio biológico |
Material de referencia |
Valor diana (µg/l) |
Resultado (µg/l) |
VN* |
C.V. (%) |
Sesgo (%) |
|
Suero |
Medisafe Nivel 1 |
1156,58±197,06 |
1113,7±37,3 |
0,96 |
3,4 |
3,7 |
|
Medisafe Nivel 2 |
1944,00±268,92 |
1941,7±33,3 |
1,00 |
1,7 |
0,1 |
|
|
Orina |
BIO-RAD Nivel 1 |
10,3±2,1 |
11,6±0,4 |
1,13 |
3,7 |
12,6 |
|
BIO-RAD Nivel 2 |
56±11 |
55,4±1,4 |
0,99 |
2,5 |
1,1 |
|
|
NIST 2670a Nivel 2 |
110±4 |
105,0±1,6 |
0,95 |
1,6 |
4,5 |
* VN: Valor normalizado (Resultado/Valor diana)
Los requisitos que tiene que cumplir el método, según el protocolo de validación para determinaciones en muestras biológicas, son que tanto el coeficiente de variación
(C.V.) para cada nivel de concentración como el sesgo relativo sean inferiores al 10%. Como se puede apreciar en la tabla 2, estos requisitos los cumple el método propuesto para el análisis de cobre en matrices biológicas con la excepción de una muestra. Sin embargo, cabe comentar que se trata de una muestra con un contenido bajo de cobre y que el resultado obtenido está dentro del rango admitido por el fabricante.
Además de los materiales de referencia indicados, para validar el método analítico también se emplearon muestras procedentes de controles de calidad externos. En las Tablas 3 y 4 y en la Figura 2 se muestran los resultados obtenidos en los controles de calidad externos organizados por el Centro de Toxicología de Québec y por la Universidad de Erlangen.
Tabla 3: Resultados obtenidos en los programas de control de calidad externos para cobre en suero y plasma.
|
Control de calidad externo |
Analito |
Identificación de la muestra |
Resultado (µg/l) |
Diana (µg/l) |
VN |
Sesgo (%) |
|
Centro de Toxicología de Québec |
Cu en suero |
E-05-16 |
1689,1 |
1670,1 |
1,01 |
1,1 |
|
E-05-17 E-05-18 E-06-01 E-06-02 |
997,0247,71498,61174,8 |
990,6254,01511,31181,1 |
1,010,980,990,99 |
0,62,50,80,5 |
||
|
E-06-03 |
565,2 |
552,5 |
1,02 |
2,3 |
||
|
Universidad |
Cu en |
36A |
1023,3 |
1120,8 |
0,91 |
8,7 |
|
de Erlangen |
plasma |
36B |
1230,2 |
1329,5 |
0,93 |
7,5 |
Tabla 4: Resultados obtenidos en los programas de control de calidad externos para cobre en orina.
|
Control de calidad externo |
Analito |
Identificación de la muestra |
Resultado (µg/l) |
Diana (µg/l) |
VN |
Sesgo (%) |
|
Centro de Toxicología de Québec |
Cu en orina |
R-05-16 |
44,5 |
43,8 |
1,01 |
1,4 |
|
R-05-17 R-05-18 R-06-01 R-06-02 |
12,7336,636,2304,8 |
12,7323,933,7311,2 |
1,001,041,080,98 |
0,03,97,52,0 |
||
|
R-06-03 |
161,3 |
165,1 |
0,98 |
2,3 |
||
|
Universidad |
Cu en |
36A |
85,3 |
79,3 |
1,08 |
7,6 |
|
de Erlangen |
orina |
36B |
108,7 |
106,7 |
1,02 |
1,9 |
Los resultados de las muestras procedentes de controles de calidad externos, mostrados en las tablas 3 y 4, también satisfacen los requisitos del protocolo de validación seguido en este estudio, ya que en ningún caso el sesgo resultó ser superior al 10%.
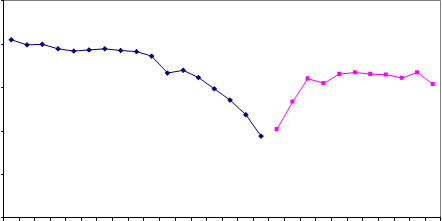
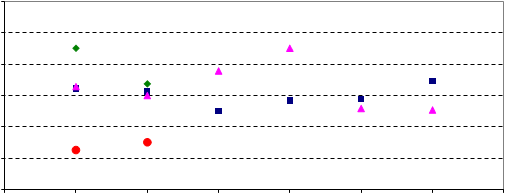
En la figura 2 están representados los resultados obtenidos, expresados en términos de valor normalizado (resultado/diana) por el laboratorio en los controles de calidad externos del Centro de Toxicología de Québec y de la Universidad de Erlangen.
1,15
 |
|
1,10 |
1,05
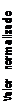 |
|
1,000,950,900,85 |
0 1 2 3 4 5 6 7
nº muestra
Cu en suero (Centro de Toxicología de Quebec) Cu en orina (Centro de Toxicología de Quebec) Cu en plasma (Universidad de Erlangen) Cu en orina (Universidad de Erlangen)




Figura 2. Representación gráfica del valor normalizado (Resultado/Valor diana) de las muestras de controles de calidad externos.
El límite de detección (LOD) [9], es decir, la concentración más baja de analito que puede ser diferenciada con un cierto nivel de confianza del blanco, se calculó como LOD=3*SB/b, en donde SB es la desviación estándar de diez inyecciones del blanco y b es la pendiente de la recta de adición. Los límites de detección obtenidos fueron 10,2µg/l de suero/plasma y 2,2µg/l de orina. Los límites de cuantificación (LOQ), calculados como LOQ=10*SB/b, fueron 34,2 µg/l de suero/plasma y 7,3µg/l de orina.
El método se estudió hasta una concentración de 2400µg/l de suero/plasma y de 800µg/l de orina. La linealidad en ese intervalo fue satisfactoria, tal y como demuestran las ecuaciones de las rectas de adición:
Suero: y = 0,01641+0,0001315 x (r2:0,99997) Orina: y = 0,01221+0,0003621 x (r2:0,99986)
CONCLUSIONES
Se ha puesto a punto un método analítico adecuado para la determinación de cobre en suero, plasma y orina en donde la preparación del material biológico para su introducción en el horno de grafito es mínima, ya que sólo es necesaria una dilución de la muestra con Tritón X-100 y HNO3 al 0,1%. De este modo se evitan tanto la contaminación de la muestra como las pérdidas de cobre. La determinación se lleva a cabo con una mineralización a 920ºC y con una temperatura de atomización de 2000ºC. Para cuantificar el cobre en el espécimen biológico se utiliza una recta de adición.
La validación del método se realizó siguiendo los requisitos que el protocolo de validación del INSHT establece para determinaciones en muestras biológicas. El método propuesto cumple los criterios establecidos, esto es, su sesgo y su precisión son inferiores al 10%, tal y como se comprobó mediante el análisis de materiales de referencia y muestras procedentes de programas de comparación interlaboratorio.
REFERENCIAS
- 1. Angerer, J.; Schaller, K. (2001) Analyses of Hazardous Substances in Biological Materials: Volume 7. ISBN: 3527270485.
- 2. Friberg, L.; Nordberg, G.F. (1986) Handbook on the Toxicology of Metals. 2nd Edition. ISBN: 0444904425.
- 3. Lauwerys, R.R.; Hoet, P. (2001) Industrial Chemical Exposure. Guidelines for Biological Monitoring. 3rd Edition. ISBN: 1566705452.
- 4. ACGIH Documentation of the Threshold Limit Values and Biological Exposure Indices.
- 5. NIOSH Manual of Analytical Methods (NMAM), Fourth Edition. (8005 & 8310).
- 6. IUPAC (1995) Pure & Applied Chemistry, 67, 8/9, 15751608.
- 7. Angerer, J.; Schaller, K.H. (1985) Analyses of Hazardous Substances in Biological Materials: Volume 4. ISBN: 3527270272.
- 8. INSHT Protocolo de validación para determinaciones en muestras biológicas de interés en Higiene Industrial. (ref. MTA/PVIII (2)/98).
http://www.mtas.es/insht/mta/I_general.htm#Protocolos9. Analytical Methods Committee (Royal Society of Chemistry) (1987) Analyst, 112, 199-204.