ID956
Ranchal Sánchez, Miguel; Jiménez Soto, Juan Manuel; López Torrico, Pablo; Infante García-Pantaleón, Félix
Departamento de Prevención de Riesgos y Relaciones Laborales Empresa Provincial de Aguas de Córdoba, S.A. (Emproacsa) Av.Mediterráneo,s/n/14011 Córdoba, España
+34 957 211 375 / emproacsa@emproacsa.es
1. MARCO REGULADOR
La Directiva 91/271/CEE, del Consejo, de 21 de mayo, sobre el tratamiento de aguas residuales urbanas, establece que los Estados miembros adoptarán las medidas necesarias para garantizar que dichas aguas son tratadas correctamente antes de su vertido. La transposición de esta Directiva comunitaria al ordenamiento jurídico español se efectúa mediante el Real Decreto-Ley 11/1995, de 28 de diciembre, por el que se establecen las normas aplicables al tratamiento de las aguas residuales urbanas. Dispone el artículo 6 de esta normativa que las aglomeraciones urbanas que se indican a continuación dispondrán de un tratamiento adecuado para sus aguas residuales, antes del 1 de enero del año 2.006, en las siguientes circunstancias:
a) Aquellas que cuenten con menos de 2.000 habitantes-equivalentes1 yviertan en aguas continentales y estuarios.
b) Aquellas que cuenten con menos de 10.000 habitantes-equivalentes y viertan en aguas marítimas.
Las estaciones depuradoras de aguas residuales (EDAR) presentan unos riesgos específicos para los trabajadores que en ella operan. Por abarcar una gran variedad de factores de riesgos (mecánicos, físicos, químicos, ergonómicos, biológicos) el sector del agua ha mostrado desde un principio una gran sensibilidad en cuanto a la implantación de adecuados sistemas de gestión de la prevención que reduzcan los índices de siniestralidad.
Por la presencia de agentes biológicos es plenamente aplicable en estas instalaciones el RD 664/97, sobre exposición a agentes biológicos. En consonancia lo dispuesto en su artículo 4, la Guía Técnica de este Reglamento señala, como estudios y actuaciones que se han de efectuar para la evaluación de los riesgos biológicos, entre otros los siguientes:
• Identificación teórica de los agentes biológicos más probables,considerando sus fuentes de exposición, reservorios, información científica y posibles estudios epidemiológicos.• Grado de virulencia, expresado como dosis infectiva mínima (DIM) que representa la cantidad más pequeña de agente biológico necesaria para provocar una infección, facilidad de propagación, gravedad de las infecciones así como eventuales tratamientos profilácticos y curativos.• Conocimiento de los modos de transmisión: aerosoles, por contacto directo e indirecto, lesiones, vectores, huéspedes intermediarios...
1 Artículo 2.f) RDL 11/1995: Habitante equivalente.- La carga orgánica biodegradable con una demanda bioquímica de oxígeno de cinco días (DBO 5), de 60 gramos de oxígeno por días.
• Vías de entrada: respiratoria, digestiva, a través de la piel o mucosas, por heridas, parenteral...
• Cantidad, volumen o concentración del agente en el material que semaneja.• Datos epidemiológicos: presencia y grado de propagación del agente, frecuencia de infecciones, inmunización de la población y papel de los reservorios.• Resistencia de agente biológico, supervivencia en las condiciones ambientales de trabajo (radiación ultravioleta, desecación...).• Posibilidad de presentación de cepas multirresistentes.• Posibilidad de desinfección.
2. OBJETO DEL ESTUDIO
En la lista de chequeo de la evaluación de riesgos de una EDAR se contempla la presencia de microorganismos en el ambiente. Sin embargo, al igual que para otros factores de riesgo presentes en estas plantas depuradoras existen unos procedimientos bien reglamentados, con la consiguiente determinación de sus medidas correctoras, no existen unos estudios exhaustivos sobre la presencia de contaminantes medioambientales en estos lugares de trabajo2.
Así, se suele incidir en la profilaxis necesaria para reducir los riesgos biológicos derivados de los trabajos con aguas residuales. Pero la concentración de hongos y esporas presentes en este entorno de trabajo casi es ajena hasta la fecha a un pormenorizado análisis en el campo de la higiene laboral, limitándonos a proteger las vías respiratorias con los preceptivos equipos de protección individual.
Se entiende, además, que una medición puntual y aislada auxiliándose, verbigratia de unas placas petri, no es suficientemente significativa, dadas las condiciones de variabilidad a la que puede estar sujeto el funcionamiento de la EDAR –condiciones del vertido, niveles de concentración de gruesos, demanda biológica de oxígeno, condiciones atmosféricas-.
Otro elemento determinante en la configuración de este estudio es la diversidad de sistemas de depuración existentes. Esa variedad en el esquema de funcionamiento de las EDAR induce a cuestionar que sean idénticos los contaminantes presentes en el aire, tanto si se trata de una EDAR que funciona con un reactor biológico, como si el mismo se diseña con un sistema de aireación de turbinas, o se trata de una planta de desecación de lodos.
Este estudio pretende abordar el conocimiento y determinación de los posibles agentes patógenos aéreos del reino Fungi y su consideración como potenciales factores de riesgo sobre los operarios de estaciones depuradoras de aguas residuales. Dada la envergadura de este proyecto, para su realización se ha contado con la inestimable ayuda del Departamento de Botánica, Ecología y Fisiología Vegetal de la Universidad de Córdoba, personalizada en el Pr. Dr. Félix Infante García Pantaleón, así como a d. Juan Manuel Jiménez Soto, Licenciado en Ciencias Medioambientales y becario de dicho Departamento, a quien quiero agradecer su dedicación en la ardua tarea de identificación y cuantificación de las colonias fúngicas.
2 Sin tratarse propiamente de una EDAR, un trabajo que podría guardar afinidad con el que aquí se presenta es el titulado “Evaluación ambiental de agentes biológicos en una planta de compostaje”. Rosa Mª Alonso, Xavier Solans y Angelina Constans.- Póster presentado en el XII Congreso Nacional de Seguridad y Salud en el Trabajo. Noviembre de 2.001.
3. METODOLOGÍA
 |
|
a. Lugares de muestreo. Inicialmente, el objeto de este proyecto se centró en el estudio aerobiológico de las estaciones depuradoras de aguas residuales de los municipios cordobeses de Montoro, Aguilar de la Frontera y Villanueva del Rey. La elección de dichas plantas respondía al diferente esquema de funcionamiento de cada una de ellas, lo cual exige una evaluación de riesgos diferenciada para detectar la presencia de estos agentes biológicos: a. EDAR de Montoro: Sistema de reactor biológico. b. EDAR de Aguilar de la Frontera: Sistema de turbinas de aireación. c. EDAR de Villanueva del Rey: Sistema de balsas para desecación de fangos. Desde el punto de vista preventivo, el sistema de reactor biológico y el de aireación de turbinas guardan grandes semejanzas en cuanto a la detección de los potenciales factores de riesgo. Para el caso que nos ocupa, y a falta de que las conclusiones del estudio se aproximen a esta hipótesis, la dispersión de aerosoles habría de ser mayor en el sistema de turbinas que en el reactor biológico, al menos en la zona adyacente a esta fase del tratamiento. |
Se distancia de las mismas el sistema de desecación de fangos, de mayor simplicidad técnica, pero en el que potencialmente intervienen otros factores de riesgo, dado que el operario ha de proceder al rastrillado de las heras. También han de contemplarse riesgos ergonómicos, al tener que retirar de las balsas ese material desechable, con el consiguiente levantamiento de polvo que conlleva el rastrillado y acarreo del fango desecado.



|
Reactor biológico: Montoro |
Turbinas de aireación: Aguilar |
Desecación de fangos: Villanueva del Rey |
No obstante la primera acotación temporal (tres meses), se consideró conveniente ampliar el tiempo del estudio a un ciclo anual para comprobar la incidencia de las variaciones estacionales en los niveles de concentración. Se ha demostrado acertada dicha ampliación, pues la distribución de variedades fúngicas en el resultado global de la muestra respecto al primer trimestre analizado ofreceun cambio sustancial.
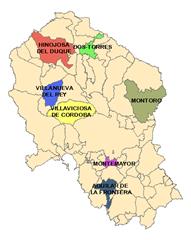
Igualmente, se ha hecho extensivo este estudio a otras EDAR de la provincia, según se observa en el mapa adjunto.
Así, a las tres depuradoras iniciales se han sumado, no tanto para determinar su perfil evolutivo, sino como contraste de niveles de concentración fúngica, las siguientes:
o EDAR de Villaviciosa: Sistema de biodiscos.
- EDAR de Hinojosa del Duque: Sistema de lagunaje.
- EDAR de Dos Torres: Sistema de reactor biológico.
- EDAR de Montemayor: Sistema de turbinas de aireación.


|
Biodiscos:Villaviciosa |
Lagunaje:Hinojosa del Duque |
|
Reactor biológico:Dos Torres |
Montemayor: Sistema de turbinas a reacción |
b. Metodología aplicada

 |
|
Como se ha dicho anteriormente, las condiciones de variabilidad a las que puede estar sometido el funcionamiento de una EDAR descartarían como suficientemente representativa una muestra aislada. Para ello, en este estudio se ha diseñado un plan de trabajo cuya aplicación es la siguiente: • Utilización simultánea de dos muestreadores aerobiológicos volumétricos (ambos captan un flujo de aire de 10 l/min.), uno de ellos con portaobjeto impregnado de silicona (muestreador no viable) de la casa Lanzoni, modelo VPPS 1000, para el conteo de esporas; y el otro mediante la utilización de una preparación o cultivo en placas Petri con cultivo de Extracto de Agar-Malta (MEA) (muestreador viable) de la marca Burkard (Portable air sampler for Agar plates), para su posterior cultivo en laboratorio e identificación de los hongos encontrados en la muestra. • Determinación de los lugares de muestreo. En cada EDAR se han delimitadotres puntos de muestreo: Y EDAR Montoro: Sala de desarenado y desengrasado, sala de deshidratación y zona de tolva de fangos. Y EDAR Aguilar de la Frontera: Sala de desarenado y desengrasado, sala de deshidratación y zona de aireación de turbinas. Y EDAR Villanueva del Rey: Rastrillado de las eras, acarreo de las sacasy zona de decantación. Y EDAR Villaviciosa: Sección de pretratamiento y Reactor de biodiscos. Y EDAR de Hinojosa del Duque: Zona de pretratamiento y zona de lagunaje. Y EDAR de Dos Torres: Zona de pretratamiento y Reactor Biológico. Y EDAR de Montemayor: Zona de exteriores. |


Lanzoni Burkard
• Tiempo de muestreo: Se han pautado en cada EDAR objeto del análisis muestras de 10 y de 20 minutos.
• Cadencia del muestreo: Se ha establecido una frecuencia quincenal para la toma de muestras en cada una de las estaciones depuradoras objeto del estudio.
• Duración del muestreo: Inicialmente, el objeto de este análisis tenía unaduración trimestral. Las captaciones comenzaron a realizarse a principios de agosto, por los mayores niveles de concentración que pueden darse en época estival.
Por la propia envergadura del proyecto, que requiere un posterior análisis en un laboratorio especializado y una disponibilidad que limitaría los cometidos propios de los Técnicos de Prevención de Emproacsa, se ha requerido la colaboración externa para poder afrontar este proyecto. Planteada la cuestión a un servicio de prevención ajeno, se contestó que su departamento de higiene no cubría ese tipo de muestreos, incrementándose en cualquier caso de una forma significativa el presupuesto habilitado al efecto de haber participado en el mismo dicho servicio de prevención.
Por tanto, se ha abierto una fructífera vía de colaboración con el departamento de Botánica, Ecología y Fisiología vegetal de la Universidad de Córdoba, que ha valorado positivamente esta línea de investigación, ofreciendo para la misma sus medios materiales y humanos.
Una vez concluida la toma de muestras y el análisis de las mismas en el laboratorio, se ha llevado a efecto la evaluación de los resultados obtenidos según el criterio determinado por el RD 664/97, comprobando la potencial incidencia sobre la salud laboral de los trabajadores que operan en estos lugares de trabajo.
• La toma de muestras se ha simultaneado con la medición de la temperatura WBGT y de la humedad relativa, efectuada mediante un medidor de estrés térmico de la marca Metrosonics, modelo Hs-32. Con ello, se pretende delimitar la relación entre temperatura y humedad y los niveles de concentración fúngica.
 |
|
c. Método de identificación. Una vez que se han obtenido las muestras sobre las placas de Petri, éstas se trasladan al laboratorio para ser incubadas en estufa a 27 ºC durante 7 días en posición inversa. De esta manera, las UFC (unidades formadoras de colonias) capturadas pueden desarrollar las estructuras somáticas y reproductoras de los hongos, necesarias para su posterior identificación. En cuanto a las muestras tomadas con el captador no viable, una vez que estas llegan al laboratorio, se procede a su sellado (colocación de un cubreobjetos sobre el portaobjetos) para evitar contaminaciones que puedan desvirtuar el estudio. Tras la incubación de las placas Petri, se cuantifican e identifican las colonias desarrolladas. Para ello se dispone del material óptico (microscopio y lupa con cámara digital y tubo de dibujo) y bibliográfico necesarios (claves y monografías). La identificación de los hongos se ha efectuado según los casos, hasta el nivel de género o de especie; aquellas colonias que no han desarrollado estructuras reproductoras se han nombrado como Micelio estéril, por último se incluyen dos grupos genéricos para incluir algunas bacterias y levaduras contabilizadas. |
4. CRONOGRAMA
El trabajo de campo de toma de muestras ha abarcado el periodo comprendido entre el 3 de agosto de 2006 y el 6 de julio de 2007, según el siguiente cronograma:
|
AGOSTO 2006 |
SEPTIEMBRE2006 |
OCTUBRE 2006 |
NOVIEMBRE2006 |
|
Montoro |
|||||||||||||||||
|
Aguilar de la Frontera |
|||||||||||||||||
|
Villanueva del Rey |
|
DICIEMBRE 2006 |
ENERO 2007 |
FEBRERO 2007 |
MARZO 2007 |
|
Montoro |
|||||||||||||||||
|
Aguilar de la Frontera |
|||||||||||||||||
|
Villanueva del Rey |
|
ABRIL 2007 |
MAYO 2007 |
JUNIO 2007 |
JULIO 2007 |
|
Montoro |
|||||||||||||||||
|
Aguilar de la Frontera |
|||||||||||||||||
|
Villanueva del Rey |
|||||||||||||||||
|
Villaviciosa, Hinojosa, Dos Torres |
|||||||||||||||||
|
Montemayor |
|
AGO 2006 |
SEPT 2006 |
OCT 2006 |
NOV 2006 |
DIC 2006 |
MEDICIONES AMBIENTALES ESTUDIO EN LABORATORIO ANÁLISIS DE DATOS ELABORACIÓN INFORME
|
ENE 2007 |
FEB 2007 |
MAR 2007 |
ABR 2007 |
MEDICIONES AMBIENTALES ESTUDIO EN LABORATORIO ANÁLISIS DE DATOS ELABORACIÓN INFORME
|
MAY 2007 |
JUN 2007 |
JUL 2007 |
AGO 2007 |
MEDICIONES AMBIENTALES ESTUDIO EN LABORATORIO ANÁLISIS DE DATOS ELABORACIÓN INFORME

5. EVALUACIÓN DE RESULTADOS
Como no podía ser de otra manera, en la realización de este estudio se ha buscado su adecuación a los criterios fijados en la Guía Técnica de desarrollo del RD 664/1997, concretamente en la clasificación de agentes biológicos –hongos- que se desglosa en su anexo II. Los trabajos en instalaciones depuradoras de aguas residuales vienen incluidos en la reducida lista indicativa de actividades sujetas a exposición de agentes biológicos, según recoge el Anexo I del citado Reglamento. Asimismo, en el Apéndice 3 de dicha Guía se reconoce la limitación de la metodología propuesta para la identificación y evaluación de agentes biológicos en los lugares de trabajo, al no existir en la actualidad datos suficientes para establecer de modo fiable relaciones dosis-efecto/respuesta de modo similar al establecido para los agentes químicos, indicándose la dificultad de delimitar valores límites ambientales que sirvan como criterio de referencia en la misma línea que para los agentes químicos (VLA, TLV). Sin embargo, es la propia Guía Técnica la que, a pesar de las limitaciones descritas, considera de gran utilidad este tipo de estudios.
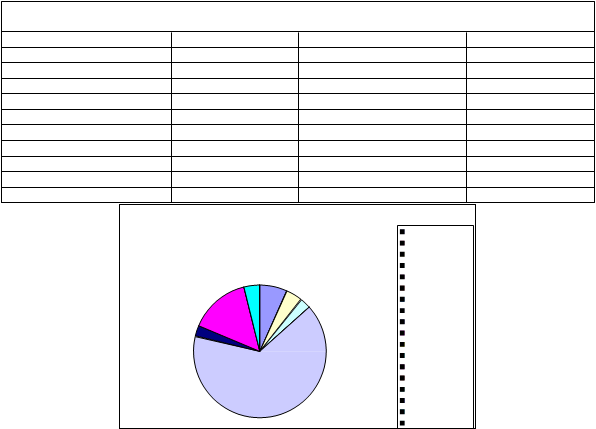
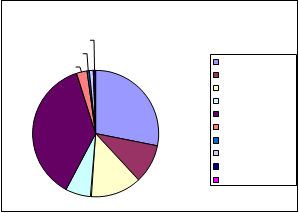
a. DISTRIBUCIÓN POR GÉNEROS
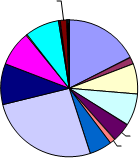
En la totalidad de las muestras analizadas por sistema de impactación con muestreador viable, se han detectado, en ufc/m³, las siguientes concentraciones fúngicas:
Cladosporium sp. 2.428 Aspergillus niger 1.606 Micelios estériles 730 Rhizopus stolonifer 674 Alternaria sp. 669 Mucor sp. 484 Cunninghamella sp. 431 Aspergillus flavus 162 Absidia sp. 152
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Penicillium sp. |
108 |
||
|
Ulocladium sp. |
34 |
||
|
Chrysonilia sitophila |
26 |
||
|
Curcularia sp. |
25 |
||
|
Syncephalastrum sp. |
20 |
||
|
Dreschlera sp. |
5 |
||
|
Bacterias |
875 |
||
|
Levaduras |
784 |
||
|
SIN IDENTIFICAR |
1 |
||
|
Total |
9.213 |
||
|
PROPORCIÓN DE GENEROS AISLADOS. MUESTREADOR VIABLE |
||||
|
2% |
Aspergillus niger |
|||
|
Aspergillus flavus |
||||
|
8% |
Rhizopus |
|||
|
Alternaria |
||||
|
Cuninghamella |
||||
|
9% |
Penicillium |
|||
|
2% |
Mucor |
|||
|
Cladosporium |
||||
|
7% |
Bacteria |
|||
|
9% |
Levadura |
|||
|
Monilia sitophila |
||||
|
Micelio esteril |
||||
|
7% |
Ulocladium |
|||
|
Absidia |
||||
|
5% |
Syncephalastrum |
|||
|
1% |
Drechslera |
|||
|
26% |
5% |
Curvularia lunata |
||
|
SIN IDENTIFICAR |
||||
En este grafico se aprecia que el genero fúngico con mayor presencia en todos los muestreos realizados es Cladosporium sp. representando algo más de un cuarto sobre el total de UFC/m3 encontrados, seguido de cerca por una especie de hongos potencialmente peligrosos como es Aspergillus niger, el cual se trata de uno de los géneros dominantes, sumando entre las dos especies identificadas (A. niger y A. flavus) un 17% del total. La presencia de colonias de Aspergillus es particularmente notoria en la EDAR de Montoro, representando un 27% del total de dicha depuradora.

 |
|
Respecto a los resultados obtenidos con el muestreador no viable son los siguientes: |
Cladosporium sp. 1.585 Aspergillus niger 1.301 Alternaria sp. 940 Aspergillus flavus 280 Penicillium sp. 217
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de |
UFC/m3 |
|
Absidia sp. |
183 |
|||
|
Ulocladium sp. |
57 |
|||
|
Curcularia sp. |
32 |
|||
|
Dreschlera sp. |
17 |
|||
|
SIN IDENTIFICAR |
3 |
|||
|
Total |
4.615 |
|||
En la utilización de esta segunda técnica se observa que el número de géneros detectados en menor que en el anterior. Ello es debido a que existe una serie de hongos que pertenecen a un grupo distinto llamado Mucorales. Este grupo tiene un gran importancia medioambiental y entre los géneros más abundantes se
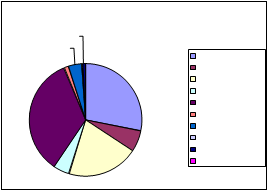
PROPORCIÓN DE GÉNEROS AISLADOS. MUESTREO NO VIABLE1%4%1%
35%
28%
6%
Aspergillus niger Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera Curvularia lunata SIN IDENTIFICAR5% 20%
encuentran algunos de los muestreados con la técnica viable, como pueden ser:
Rhizopus, Mucor, Cunninghamella o Syncephalastrum.
Anteriormente se hizo referencia a las significativas diferencias detectadas entre la distribución total de los taxones al culminar el ciclo anual y los obtenidos durante los tres primeros meses cuya cuantificación respecto al muestreo viable, fue la siguiente:
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Aspergillus niger |
1.176 |
Absidia sp. |
100 |
|
Rhizopus stolonifer |
569 |
Penicillium sp. |
34 |
|
Cunninghamella sp. |
401 |
Ulocladium sp. |
34 |
|
Mucor sp. |
389 |
Cladosporium sp. |
28 |
|
Alternaria sp. |
298 |
Chrysonilia sitophila |
8 |
|
Micelios estériles |
158 |
Levaduras |
221 |
|
Aspergillus flavus |
112 |
Bacterias |
22 |
Total 3.550
En este primer periodo de muestreo es el Aspergillus Níger la especie dominante.

|
|
|
|
Aspergillus niger Vista a la lupa |
Aspergillus niger Vista al microscopio |
Vista de Drechslera sp. al microscopio
b. Distribución de géneros por EDAR
TÉCNICA VIABLE
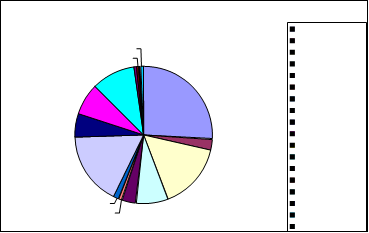
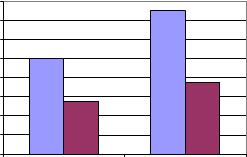
PROPORCIÓN TOTAL DE GÉNEROS: MONTORO
1%1%
Aspergillus niger Aspergillus flavus Rhizopus
Alternaria
7%
6%
17%10%
1%3% 7%1%
26%
3%
16%
Cuninghamella Penicillium Mucor Cladosporium Bacteria Levadura Monilia sitophila Micelio esteril Ulocladium Absidia
Syncephalastrum Drechslera Curvularia lunata SIN IDENTIFICAR
|
MUESTREADOR VIABLE MONTORO |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
527 |
Penicillium sp. |
27 |
|
Aspergillus niger |
798 |
Ulocladium sp. |
13 |
|
Micelios estériles |
315 |
Chrysonilia sitophila |
0 |
|
Rhizopus stolonifer |
482 |
Curcularia sp. |
25 |
|
Alternaria sp. |
224 |
Syncephalastrum sp. |
10 |
|
Mucor sp. |
43 |
Dreschlera sp. |
0 |
|
Cunninghamella sp. |
105 |
Bacterias |
177 |
|
Aspergillus flavus |
82 |
Levaduras |
229 |
|
Absidia sp. |
20 |
SIN IDENTIFICAR |
1 |
|
Total |
3.076 |
||
|
MUESTREADOR VIABLE VILLANUEVA del REY |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
252 |
Penicillium sp. |
23 |
|
Aspergillus niger |
190 |
Ulocladium sp. |
0 |
|
Micelios estériles |
78 |
Chrysonilia sitophila |
0 |
|
Rhizopus stolonifer |
85 |
Curcularia sp. |
0 |
|
Alternaria sp. |
215 |
Syncephalastrum sp. |
0 |
|
Mucor sp. |
128 |
Dreschlera sp. |
0 |
|
Cunninghamella sp. |
113 |
Bacterias |
448 |
|
Aspergillus flavus |
20 |
Levaduras |
287 |
|
Absidia sp. |
132 |
SIN IDENTIFICAR |
0 |
|
Total |
1.969 |
||
PROPORCIÓN TOTAL DE GÉNEROS: VILLANUEVA DEL REY
Aspergillus niger Aspergillus flavus Rhizopus Alternaria
15%7%4%
23%10%
13%
1%4%
11%
6%
1%
6%
Cuninghamella Penicillium Mucor Cladosporium Bacteria Levadura Monilia sitophila Micelio esteril Ulocladium Absidia
Syncephalastrum Drechslera Curvularia lunata SIN IDENTIFICAR

Taxones Nº de UFC/m3 Taxones Nº de UFC/m3 Cladosporium sp. 690 Penicillium sp. 43 Aspergillus niger 453 Ulocladium sp. 22 Micelios estériles 287 Chrysonilia sitophila 26 Rhizopus stolonifer 48 Curcularia sp. 0 Alternaria sp. 145 Syncephalastrum sp. 10 Mucor sp. 313 Dreschlera sp. 5 Cunninghamella sp. 213 Bacterias 145 Aspergillus flavus 60 Levaduras 143 Absidia sp. 0 SIN IDENTIFICAR 0 Total 2.603
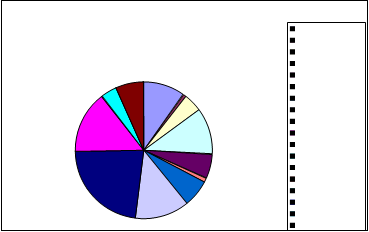
PROPORCIÓN TOTAL DE GÉNEROS: AGUILAR DE LA FRONTERA
1%
Aspergillus niger Aspergillus flavus Rhizopus Alternaria Cuninghamella
1%6%
6%
27%11%17%
2%2%
6%
8%
2%
12%
Penicillium Mucor Cladosporium Bacteria Levadura Monilia sitophila Micelio esteril Ulocladium Absidia
Syncephalastrum Drechslera Curvularia lunata SIN IDENTIFICAR
EDAR Villaviciosa
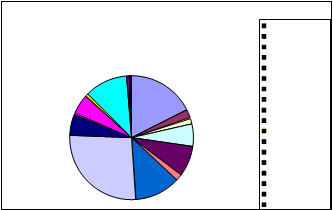
|
MUESTREADOR VIABLE VILLAVICIOSA |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
145 |
Penicillium sp. |
0 |
|
Aspergillus niger |
65 |
Ulocladium sp. |
0 |
|
Micelios estériles |
30 |
Chrysonilia sitophila |
0 |
|
Rhizopus stolonifer |
35 |
Curcularia sp. |
0 |
|
Alternaria sp. |
20 |
Syncephalastrum sp. |
0 |
|
Mucor sp. |
0 |
Dreschlera sp. |
0 |
|
Cunninghamella sp. |
0 |
Bacterias |
60 |
|
Aspergillus flavus |
0 |
Levaduras |
25 |
|
Absidia sp. |
0 |
SIN IDENTIFICAR |
0 |
|
Total |
380 |
||
PROPORCIÓN TOTAL DE GÉNEROS: VILLAVICIOSA
8%
Aspergillus niger Aspergillus flavus Rhizopus Alternaria Cuninghamella
7%
16%
38%17%
9%
5%
Penicillium
Mucor Cladosporium Bacteria Levadura Monilia sitophila Micelio esteril Ulocladium Absidia
Syncephalastrum Drechslera Curvularia lunata SIN IDENTIFICAR
EDAR Hinojosa del Duque
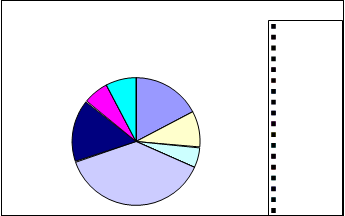 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
EDAR Dos Torres

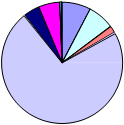
MUESTREADOR VIABLE DOS TORRES
Taxones Nº de UFC/m3 Taxones Nº de UFC/m3
Cladosporium sp. 245 Penicillium sp. 0
Aspergillus niger 0 Ulocladium sp. 0
Micelios estériles 15 Chrysonilia sitophila 0
Rhizopus stolonifer 15 Curcularia sp. 0
Alternaria sp. 10 Syncephalastrum sp. 0
Mucor sp. 0 Dreschlera sp. 0
Cunninghamella sp. 0 Bacterias 10
Aspergillus flavus 0 Levaduras 55
Absidia sp. 0 SIN IDENTIFICAR 0
Total 375
PROPORCIÓN TOTAL DE GÉNEROS: DOS TORRES
Aspergillus niger Aspergillus flavus Rhizopus Alternaria15%3%4% 7%4%3%
65%
Cuninghamella Penicillium Mucor Cladosporium Bacteria Levadura Monilia sitophila Micelio esteril Ulocladium Absidia
Syncephalastrum Drechslera Curvularia lunata SIN IDENTIFICAR
EDAR Montemayor
|
MUESTREADOR VIABLE MONTEMAYOR |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
10 |
Penicillium sp. |
0 |
|
Aspergillus Níger |
15 |
Ulocladium sp. |
0 |
|
Micelios estériles |
0 |
Chrysonilia sitophila |
0 |
|
Rhizopus stolonifer |
10 |
Curcularia sp. |
0 |
|
Alternaria sp. |
0 |
Syncephalastrum sp. |
0 |
|
Mucor sp. |
0 |
Dreschlera sp. |
0 |
|
Cunninghamella sp. |
0 |
Bacterias |
0 |
|
Aspergillus flavus |
0 |
Levaduras |
0 |
|
Absidia sp. |
0 |
SIN IDENTIFICAR |
0 |
|
Total |
35 |
||
|
PROPORCIÓN TOTAL DE GÉNEROS: |
|||
|
MONTEMAYOR |
Aspergillus niger |
||
|
Aspergillus flavus |
|||
|
Rhizopus |
|||
|
Alternaria |
|||
|
Cuninghamella |
|||
|
Penicillium |
|||
|
Mucor |
|||
|
Cladosporium |
|||
|
Bacteria |
|||
|
43% |
Levadura |
||
|
Monilia sitophila |
|||
|
Micelio esteril |
|||
|
Ulocladium |
|||
|
Absidia |
|||
|
Syncephalastrum |
|||
|
Drechslera |
|||
|
Curvularia lunata |
|||
|
SIN IDENTIFICAR |
|||
EDAR Montoro
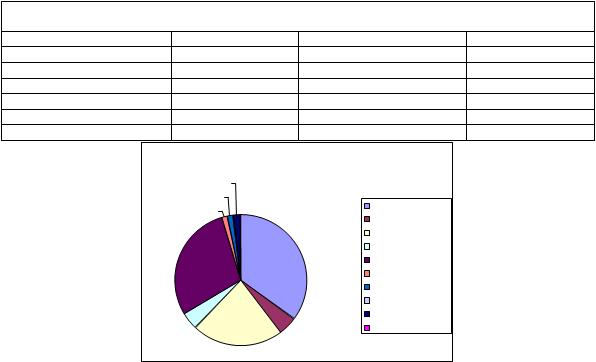

TECNICA NO VIABLE
MUESTREADOR NO VIABLE MONTORO
Taxones Nº de UFC/m3 Taxones Nº de UFC/m3
Cladosporium sp. 465 Penicillium sp. 74
Aspergillus Níger 567 Ulocladium sp. 22
Alternaria sp. 358 Dreschlera sp. 2
Aspergillus flavus 78 Curcularia sp. 25
Absidia sp. 25 SIN IDENTIFICAR 0
Total 1.622
PROPORCIÓN DE GÉNEROS AISLADOS: MONTORO2%2%1%
29%
5%
34%
5%
Aspergillus niger Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera Curvularia lunata SIN IDENTIFICAR
22%
EDAR Villanueva del Rey
|
MUESTREADOR NO VIABLE VILLANUEVA del REY |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
242 |
Penicillium sp. |
47 |
|
Aspergillus niger |
222 |
Ulocladium sp. |
0 |
|
Alternaria sp. |
244 |
Dreschlera sp. |
0 |
|
Aspergillus flavus |
55 |
Curcularia sp. |
0 |
|
Absidia sp. |
139 |
SIN IDENTIFICAR |
0 |
|
Total |
949 |
||
PROPORCIÓN DE GÉNEROS AISLADOS: VILLANUEVA DEL REY
26%
15%
5%
23%
6%
25%
Aspergillus niger Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera Curvularia lunata SIN IDENTIFICAR
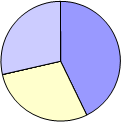
EDAR Aguilar de la Frontera
 |
|
MUESTREADOR NO VIABLE AGUILAR de la FRONTERA |
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
485 |
Penicillium sp. |
84 |
|
Aspergillus niger |
364 |
Ulocladium sp. |
35 |
|
Alternaria sp. |
171 |
Dreschlera sp. |
15 |
|
Aspergillus flavus |
131 |
Curcularia sp. |
7 |
|
Absidia sp. |
8 |
SIN IDENTIFICAR |
0 |
|
Total |
1.300 |
PROPORCIÓN DE GÉNEROS AISLADOS: AGUILAR DE LA FRONTERA

1%1%3%
37%
28%
10%
Aspergillus niger
Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera Curvularia lunata SIN IDENTIFICAR
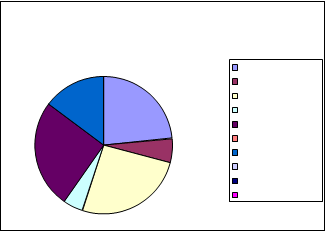
EDAR Villaviciosa
 |
|
6% 13% |
|
MUESTREADOR NO VIABLE VILLAVICIOSA |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
124 |
Penicillium sp. |
4 |
|
Aspergillus niger |
54 |
Ulocladium sp. |
0 |
|
Alternaria sp. |
37 |
Dreschlera sp. |
0 |
|
Aspergillus flavus |
4 |
Curcularia sp. |
0 |
|
Absidia sp. |
8 |
SIN IDENTIFICAR |
0 |
|
Total |
231 |
||
PROPORCIÓN DE GÉNEROS AISLADOS: VILLAVICIOSA
3% Aspergillus niger
54%
23%
2%
Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera16%
Curvularia lunata SIN IDENTIFICAR2%
EDAR Dos Torres
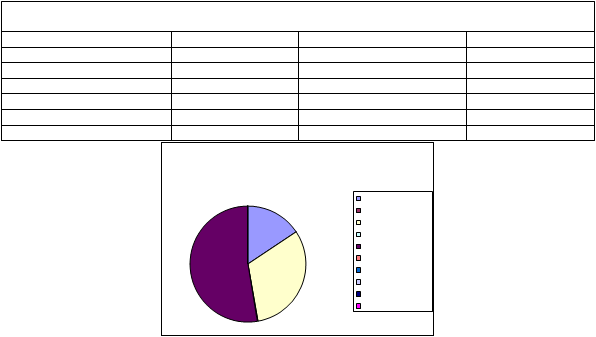
MUESTREADOR NO VIABLE DOS TORRES
 |
|
Taxones Nº de UFC/m3 Taxones Nº de UFC/m3 Cladosporium sp. 108 Penicillium sp. 8 Aspergillus niger 38 Ulocladium sp. 0 Alternaria sp. 65 Dreschlera sp. 0 Aspergillus flavus 12 Curcularia sp. 0 Absidia sp. 3 SIN IDENTIFICAR 0 Total 279 |
PROPORCIÓN DE GÉNEROS AISLADOS: DOS TORRES
52%
16%
32%
Aspergillus niger Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera Curvularia lunata SIN IDENTIFICAR
0%
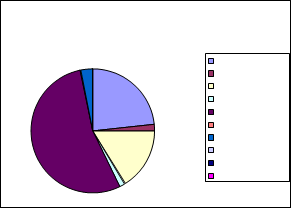
EDAR Montemayor
|
MUESTREADOR NO VIABLE MONTEMAYOR |
|||
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
5 |
Penicillium sp. |
0 |
|
Aspergillus niger |
24 |
Ulocladium sp. |
0 |
|
Alternaria sp. |
0 |
Dreschlera sp. |
0 |
|
Aspergillus flavus |
0 |
Curcularia sp. |
0 |
|
Absidia sp. |
0 |
SIN IDENTIFICAR |
0 |
|
Total |
29 |
||
PROPORCIÓN DE GÉNEROS AISLADOS: MONTEMAYOR
17%
Aspergillus niger Aspergillus flavus Alternaria Penicillium Cladosporium Ulocladium Absidia Drechslera Curvularia lunata SIN IDENTIFICAR83%
 |
|
c. Distribución temporal |
TECNICA VIABLE
EDAR Montoro

EVOLUCION TEMPORAL POR EDAR Y ZONA DE MUESTREO: MONTORO
400
350
300
250
![]()
200
150
100
50
07/09/200627/09/200619/10/200609/11/200630/11/200619/01/200709/02/200702/03/200723/03/200720/04/200717/05/200729/06/2007
0
Pretratamiento Deshidratación Exterior Decantador
ZONA DE MUESTREO
EDAR Villanueva del Rey
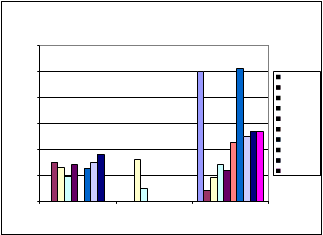
EVOLUCIÓN TEMPORAL POR EDAR Y ZONA DE MUEST REO: VILLANUEVA DEL REY
300
250
200
![]()
150
100
50
20/09/200610/10/200602/11/200622/11/200611/01/200701/02/200722/02/200716/03/200709/04/200730/04/2007
0
Rastrillado de lodos Alzado de lodos Exterior
ZONA DE MUESTREO
EDAR Aguilar de la Frontera
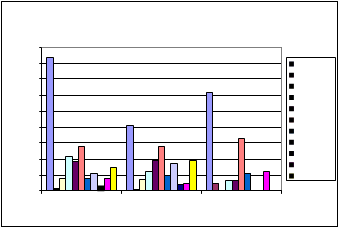
EVOLUCION TEMPORAL POR EDAR Y ZONA DE MUESTREO: AGUILAR DE LA FRONTERA
450
400
350
300
250
![]()
200
150
100
50
15/09/200604/10/200627/10/200615/11/200625/01/200716/02/200709/03/200730/03/200726/04/200731/05/200706/07/2007
0
Pretratamiento Deshidratación Exterior
ZONA DE MUESTREO
EDAR Villaviciosa
EVOLUCIÓN TEMPORAL POR EDAR Y ZONA DE MUESTREO: VILLAVICIOSA
160
 |
|
140120 |
100
![]()
![]()
3 80 30/04/200713/06/2007 60 40 20 0 Pretratamiento ZONA DE MUESTREO Exterior 3 200 30/04/200713/06/2007 150 100 50 0 Pretratamiento ZONA DE MUESTREO Exterior EDAR Hinojosa del Duque
EVOLUCIÓN TEMPORAL POR EDAR Y ZONA DE MUESTREO: HINOJOSA DEL DUQUE
400
350
300
250
![]()
![]()
3 30/06/2007 100 50 0 Pretratamiento ZONA DE MUESTREO Exterior EDAR Dos Torres
EVOLUCIÓN T EMPORAL POR EDAR Y ZONA DE MUESTREO: DOS TORRES
250
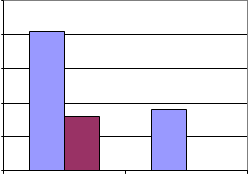 |
|
200 |
150
![]()
|
13/06/2007d. Incidencia comparativa de temperatura y humedad |
Unos de los aspectos que se ha pretendido abordar en el estudio es la interrelación existente entre la formación de concentraciones fúngicas y las condiciones ambientales existentes. Como se ha señalado anteriormente, junto alas captaciones por muestreadores viables y no viables, se ha procedido a la medición de las condiciones termohigrométricas en el momento de la toma de muestras. Concretamente se ha pautado la temperatura WBGT exterior y la humedad relativa del punto de muestreo, lo cual se ha representado, con carácter global, en las siguientes gráficas:
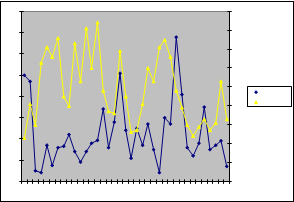
 |
|
35 400400 9030 350 350 80 |
30025
2502020015150
10100
5 50
temperatura ufc/m³
300
250
200
150
100
5070
60
50 ufc/m³ humedad 40
30
20
10
0 01 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37
0 01 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37
6. CONCLUSIONES
La primera nota destacable debe centrarse en la aleatoriedad de las concentraciones fúngicas, comprobándose la dificultad de estandarizar estos factores de riesgo, tanto en lo referente a la repercusión de las variables estacionales, como en la determinación de la variedad dominante. A título de ejemplo, se muestran las conclusiones provisionales efectuadas en las mediciones efectuadas hasta el de noviembre de 2.006 y las resultantes al finalizar el estudio.
MEDICIONES PROVISIONALES (30 de noviembre de 2006)
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Aspergillus niger |
1.176 |
Absidia sp. |
100 |
|
Rhizopus stolonifer |
569 |
Penicillium sp. |
34 |
|
Cunninghamella sp. |
401 |
Ulocladium sp. |
34 |
|
Mucor sp. |
389 |
Cladosporium sp. |
28 |
|
Alternaria sp. |
298 |
Chrysonilia sitophila |
8 |
|
Micelios estériles |
158 |
Levaduras |
221 |
|
Aspergillus flavus |
112 |
Bacterias |
22 |
|
Total |
3.550 |
MEDICIONES FINALES (6 de julio de 2007)
|
Taxones |
Nº de UFC/m3 |
Taxones |
Nº de UFC/m3 |
|
Cladosporium sp. |
2.428 |
Penicillium sp. |
108 |
|
Aspergillus niger |
1.606 |
Ulocladium sp. |
34 |
|
Micelios estériles |
730 |
Chrysonilia sitophila |
26 |
|
Rhizopus stolonifer |
674 |
Curcularia sp. |
25 |
|
Alternaria sp. |
669 |
Syncephalastrum sp. |
20 |
|
Mucor sp. |
484 |
Dreschlera sp. |
5 |
|
Cunninghamella sp. |
431 |
Bacterias |
875 |
|
Aspergillus flavus |
162 |
Levaduras |
784 |
|
Absidia sp. |
152 |
SIN IDENTIFICAR |
1 |
|
Total |
9.213 |
Se aprecia que la variedad de Aspergillus Níger, claramente dominante en los resultados provisionales, es ampliamente superada por la de Cladosporium, cuya presencia en los muestreos acumulados hasta el 30 de noviembre de 2006 era apenas relevante.
3000
2500
2000
1500
muestreo f inalmuestreo hasta 30/11/06
1000
500
0
![]()
![]()
![]()

![]()
![]()

![]()
![]()
![]()
![]()

![]()

![]()
![]()
![]()
No obstante la dificultad expresada, del estudio puede extraerse una serie de consecuencias, recomendándose desde el punto de vista preventivo una serie de medidas correctoras. Así, en consonancia con el RD 664/97, la considerable presencia de UFC en estos lugares de trabajo induce a adoptar una serie de medidas preventivas que trascienden el propio marco fijado en el Anexo II de la citada norma preventiva.
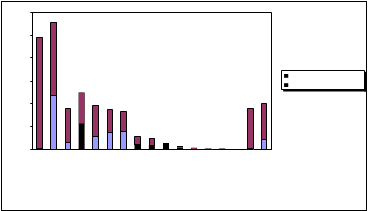 |
|
Concretamente, en el Anexo II del RD 664/97, dentro de la clasificación de agentes biológicos, se incluyen en la relación de hongos Aspergillus fumigatus y Cladosporium bantianum o C. trichoides, los cuales se asignan, respectivamente, en los Grupos 2 y 33, teniendo ambas como nota distintiva la letra A.4 Asimismo, no ha de olvidarse que las estaciones depuradoras de aguas residuales son lugares de trabajo en los que confluyen diversos focos de contaminación, y la presencia de bioaerosoles potencialmente peligrosos no es el único factor de riesgo infeccioso al que pueden estar expuestos los trabajadores de dichas plantas. A pesar de estos condicionantes, sí pueden extraerse una serie de conclusiones básicas de las actuaciones practicadas hasta la fecha:
3 En la tabla I que desarrolla el artículo 3 RD 664/97 se esquematizan las características de los distintos agentes biológicos para su clasificación dentro de un grupo de riesgo determinado: |
|
AGENTES BIOLÓGICOS DEL GRUPO DE RIESGO |
RIESGO INFECCIOSO |
RIESGO DE PROPAGACIÓN A LA COLECTIVIDAD |
PROFILAXIS TRATAMIENTO EFICAZ |
O |
|
1 |
Poco probable que cause enfermedad |
NO |
Innecesario |
|
|
2 |
Pueden causar una enfermedad y constituirun peligro para los trabajadores |
Poco probable |
Posible generalmente |
|
|
3 |
Puede provocar una enfermedad grave yconstituir un serio peligro para los trabajadores |
Poco probable |
Posible generalmente |
|
|
4 |
Provocan una enfermedad grave yconstituyen un serio peligro para los trabajadores |
Elevado |
No conocido enactualidad |
la |
4 Letra A: Posibles efectos alérgicos
II RD 664/97, al señalar que la inclusión en la lista de un determinado agente no significa su implícita y automática clasificación en el grupo I.
3. Respecto a la distribución de las diversas variedades fúngicas, tambiénencontramos diferencias sustanciales entre las diversas depuradoras analizadas. Es destacable que el carácter dominante del Aspergillus Níger durante la elaboración de los resultados provisionales, tan sólo se mantiene en la EDAR de Montoro. Curiosamente, en otra EDAR de reactor
 |
|
biológico, cual es la de Dos Torres, no se ha detectado en lasmediciones efectuadas la presencia de esta especie fúngica. Todo lo contrario, la dominancia del Cladosporium deviene absoluta durante el tiempo de muestreo en varias de las EDAR analizadas.
estandarizar, sí se observa una relación directa entre humedad y la formación de colonias. También es tangible la incidencia de la |
5 La otra EDAR con sistema de aireación de turbinas analizada (Montemayor) presenta en la muestra analizada bajos niveles de taxones, siendo reducidas las variedades fúngicas detectadas.
temperatura, aun cuando esta relación se distorsiona un tanto en las mediciones finales –que en su conjunto vienen a coincidir con las mediciones de las EDAR complementarias –aquellas que no han centrado la parte esencial del estudio-.
9. Tanto por los niveles de Cladosporium, y Aspergillus como por la identificación de especies potencialmente patógenas, se propone hacer extensivas a las estaciones depuradoras de aguas residuales las medidas de contención englobadas en los Anexos IV y V del RD 664/97 que, comprendidas en el grupo 2, se adecuen a las características de una EDAR, en concreto:
a. Restringir el acceso al personal designado en estos lugares de trabajo, limitando el tiempo de permanencia en aquellos lugares donde se ha comprobado mayores niveles de concentración – sala de pretratamiento y sala de deshidratación-.
b. Adecuado almacenamiento de los sistemas de concentración de gruesos que minimicen la dispersión de bioaerosoles en el ambiente y uso para operaciones específicas –rastrillado de lodos, manipulación de cuchara bivalva- de elementos protectores de la respiración, así como trajes desechables.
c. Delimitar procedimientos de desinfección específicos una vez que se han efectuado las operaciones a las que se hace referencia en el punto anterior.
d. Colocación de señales de peligro biológico.
Papers relacionados